
 |
| THERMO-CHIMIE
& TRAITEMENT THERMIQUE des SAPHIRS (et corindons) |
|
|
Si l'on parle de traitement thermique sur les
corindons, on utilisera probablement les thermes de "pression partielle
en oxygène" et "pression partielle en hydrogène"
en parlant de l'atmosphère à l'intérieur du four. A haute température, l'état de
valence des impuretés avec la concentration et la nature des points
de défaut dans un cristal d'oxyde (comme le saphir) peuvent être
changés en modifiant la pression partielle en oxygène et
par conséquent changer la couleur. En changeant le ratio de méthane et
d'oxygène alimentant la flamme du four, l'ensemble des pressions
partielles en oxygène et hydrogène des gaz de combustion
qui font l'atmosphère du four peuvent être contrôlées
sur une grande gamme mais pas de façon indépendante. Dans une autre approche du traitement thermique,
les pierres sont empaquetées avec du charbon ou des sucres dans
des creusets partiellement scellés pour créer une atmosphère
réductrice. Avec la présence du carbone, la pression partielle à 1300°C et 1800°C doit être respectivement inférieure à 10-16 et 10-14 atmosphère (atm). Ce qui n'est généralement pas
reconnu sur ce type de réduction c'est l'importance du rôle
de l'hydrogène. |
|
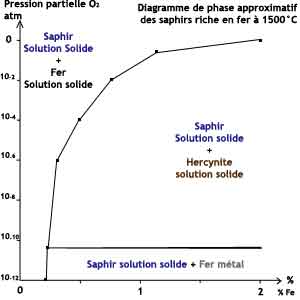
| La
précipitation de l'hercynite (Fe(II)Al2O4)
"spinelle de fer" peut contraindre les conditions de réductions
dans les saphirs à haute teneur en fer. De fait, la précipitation de l'hercynite limite la profondeur de la réduction pour les saphirs riches en fer. |
|
| Les
profils température / temps pour les traitements thermiques des corindons
sont le plus souvent établis en fonction de la durée de vie
des manchons renfermant les pierres et des éléments du four
que pour des raisons particulières de traitement des saphirs. A 1700°C la diffusion des points de défaut répondants à la pression partielle en oxygène, diffusion d'hydrogène et dissolution de rutile requière moins d'une heures pour équilibrer 15 ct de pierres (dans le cas de l'étude d'un traitement des saphirs du Montana cf article complet G&G winter 1993). De ce fait, une heure à cette température serai suffisant. La grande résistance des corindons aux chocs thermiques pouvant induire des fracture, peu permettre un chauffage à 1700°C en une heure ou moins et un refroidissement avec la même rapidité. Toutefois les composants du four peuvent ce détériorer rapidement dans ces conditions. De ce fait les cycles de chauffe et refroidissement sont plus fonction de raisons économiques que thermochimique. |
|
| Copyright © 2000-2015 Geminterest v7.5 Tous droits réservés pour tous pays |
|||